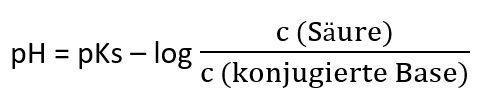Säure-Basen-Chemie
pH-Wert
Mithilfe des pH-Werts kann man bestimmen wie sauer oder basisch eine Lösung ist. Die pH-Wert-Skala geht von 1 bis 14. Je niedriger der pH-Wert, desto saurer ist die Lösung.
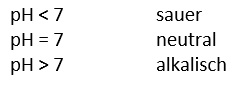
Der pH-Wert wird auch als "negativer dekadischer Logarithmus der Hydroniumionen-Konzentration" betitelt. Dies bedeutet, dass die saure oder alkalische Eigenschaft einer Lösung von der Konzentration der H+-Ionen abhängt.
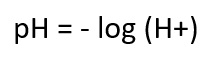
der pOH-Wert gibt die Konzentration der Hydroxidionen (OH −-Ionen) an.

Indikator
Indikatoren ändern ihre Farbe ab einem bestimmten pH-Wert. Da das Menschliche Auge immer die Farbe erkennt, die im Überschuss vorhanden ist, erfolgt der Farbwechsel sehr schnell an einem gewissen Punkt. Dieser Punkt wird auch "Umschlagspunkt" genannt.
Bei Neutralisationen werden Indikatoren hinzugefügt, um den Neutralpunkt zu ermitteln. Dabei entspricht der Umschlagspunkt des Indikators dem Neutralpunkt der Lösung.
Ein bekannter Indikator ist der Universalindikator. Dieser ist ein Gemisch aus verschiedenen Indikatoren. Er zeigt jeweils unterschiedliche Farben für alle 14 pH-Wert-Stufen an.
Säure
Säuren geben in wässrigen Lösungen Hydroniumionen ab. Ihr pH-Wert liegt bei unter 7. Säuren wirken korrosiv und zerstören Kalk. Außerdem leiten sie den elektrischen Strom.

Lauge
Laugen geben in wässrigen Lösungen Hydroxidionen ab. Ihr pH-Wert liegt bei über 7. Laugen sind flüssig und fühlen sich seifig an. Auch Laugen leiten den elektrischen Strom.
Neutralisation
Als Neutralisation wird die Reaktion zwischen Säuren und Laugen bezeichnet. Dabei reagieren H3O+-Ionen und OH−-Ionen miteinander und bilden Wasser (H2O). In einer neutralen Lösung ist die H3O+-Ionen-Konzentration gleich der Konzentration der OH−-Ionen.

Ampholyte
Ein Ampholyt ist ein Stoff, der in einer Säure-Base-Raktion sowohl als Säure als auch als Base wirken kann. Der bekannteste Ampholyt ist Wasser.
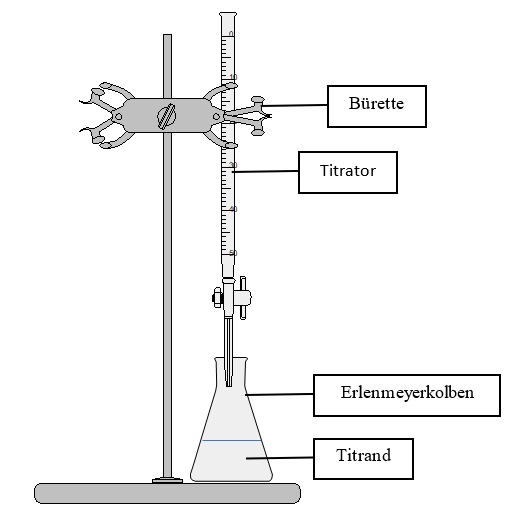
Titration
Bei einer Titration wird eine Lösung mit bekannter Konzentration (Titrator) Tropfen für Tropfen einer bekannten Substanz mit unbekannter Konzentration (Titrand) zugegeben. Dies geschieht bis zum Erreichen des Äquivalenzpunktes mithilfe einer Bürette. Dieser ist erreicht, wenn die Stoffmenge des zugegebenem Titrators gleich der Stoffmenge des Titranden ist. Um das Erreichen des Äquivalenzpunktes zu erkennen, wird ein bestimmter Indikator eingesetzt. Das Volumen des Titrators wird während der Titration ermittelt und daraufhin die Konzentration des Titranden berechnet.

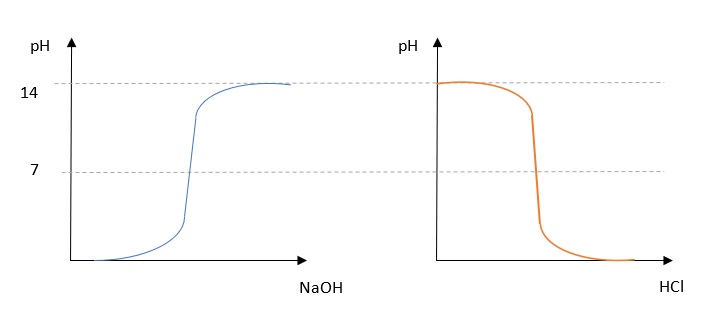
Die Tatsache, ob die Säure zur Lauge oder die Lauge zur Säure titriert wird, bestimmt das Aussehen des Graphen.
Puffer
Ein Puffer ist ein Stoffgemisch, dessen pH-Wert sich kaum ändert sobald Säuren oder Laugen hinzugegeben werden. Dies liegt daran, dass ein Puffersystem aus einer schwachen Säure und dessen korrespondierenden Base besteht. Das Puffersystem nimmt Hydroxid- oder Hydroniumionen auf, ohne dass es selbst welche freisetzt.