Redoxchemie
Oxidationszahlen
Die Oxidationszahl eines Atoms in einem Molekül kann man sich als dessen gedachte Ladung vorstellen. Sie ergibt sich, indem man beide Elektronen einer Elektronenpaarbindung jeweils dem Bindungspartner zuteilt, der die höhere Elektronegativitaumlt (EN) besitzt. Eine höhere Elektronegativität bedeutet, dass dieser Stoff eine höhere Affinität zu den Elektronen hat. Oxidationszahlen werden in römischen Zahlen ausgedrückt.
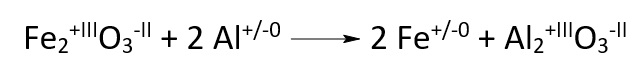
Die Summe der Oxidationszahlen eines neutralen Moleküls ist immer 0. Bei Ionen entspricht die Summe der Oxidationszahlen der Ladung des Ions.
Des Weiteren gibt es spezielle Regeln, um die Zuteilung der Oxidationszahlen zu vereinfachen. Diese gelten jeweils, insofern einer darüberstehenden Regel nicht widersprochen wird.
- Metalle haben immer positive Oxidationszahlen
- Wasserstoff hat die Oxidationszahl +I
(Ausnahmen: Peroxide & Metalloxide) - Sauerstoff hat die Oxidationszahl −II
- Halogene bekommen die Oxidationszahl −I
Oxidation
Eine Oxidation kann auf verschiedene Weisen erklärt werden.

Reduktion
Eine Reduktion kann auf verschiedene Weisen erklärt werden. Sie ist sozusagen das Gegenteil der Oxidation.

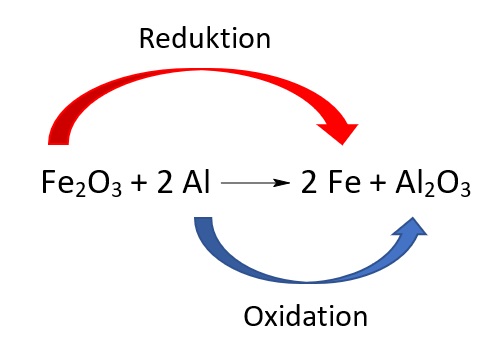
Redox-Reaktion
In einer Redox-Reaktion laufen Oxidation und Reduktion gleichzeitig ab. Es gibt in einer Redox-Reaktion jeweils ein Reduktions- und ein Oxidationsmittel.