Gleichgewicht
Unvollständige Reaktionen
Wenn Reaktionen nicht vollständig ablaufen, bleibt nach Ablauf der Reaktion ein Teil der Edukte übrig. Wie hoch der Anteil an Produkten und Edukten ist wird von der Konzentration der Stoffe und von äußeren Umständen wie Druck und Temperatur beeinflusst. Bei gleichen äußeren Umständen führen sowohl Hin- als auch Rückreaktion zu selbigem Ergebnis.
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht, d.h. die Reaktion ist nie beendet. Im Gleichgewichtszustand laufen Hin- und Rückreaktion mit gleicher Geschwindigkeit ab.
Massenwirkungsgesetz
Eine Reaktion sei:
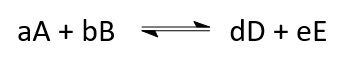
Der Pfeil in der Mitte gibt an, dass die Reaktion eine Gleichgewichtsreaktion ist. Demnach ist die Gleichgewichtskonstante der Konzentration:
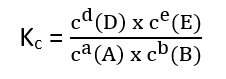
Mithilfe der Gleichgewichtskonstante kann ermittelt werden, wo sich das Gleichgewicht befindet, d.h. ob mehr Produkte oder mehr Edukte vorliegen.

Le Chatelier
Das Prinzip von Le Chatelier wird auch "Prinzip des kleinsten Zwangs" genannt. Wird also ein Zwang auf ein System ausgeübt, welches sich im Gleichgewicht befindet, so verschiebt sich das Gleichgewicht, sodass es diesem Zwang entweicht. Diese Zwänge können ganz unterschiedlich sein und das Gleichgewicht auf verschiedene Weise beeinflussen:

