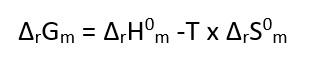Energetik
Energie
Energie ist die Fähigkeit, Arbeit zu verrichten. Die Einheit der Energie ist Joule (J).
Es gilt der Energieerhaltungssatz. Dieser besagt, dass Energie nicht aus dem Nichts erzeugt werden kann, sondern immer nur in andere Energieformen umgewandelt wird.
Es gibt verschiedene Formen der Energie, wie z.B.: Chemische Energie, kinetische Energie (Bewegungsenergie), elektrische Energie, Wärmeenergie, Lichtenergie, potentielle Energie usw.
Aktivierungsenergie
Als "Aktivierungsenergie" wird die Energie bezeichnet, welche zugefügt werden muss, damit eine Reaktion abläuft. Dies geschieht z.B. durch Erhitzen des Reaktionsgemisches.
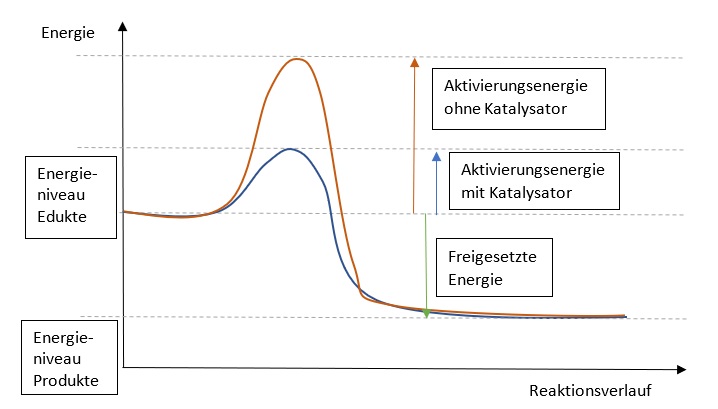
Katalysatoren sind Stoffe, die eine Reaktion beschleunigen. Sie setzen die Aktivierungsenergie herab. In der Reaktion gehen sie Bindungen mit den Edukten ein, doch treten aus der Reaktion unverändert hervor.

Enthalpie
Die Reaktionsenthalpie kann nur als Enthalpieänderung (Δ H) angegeben werden. Diese ist die ausgetauschte Wärmemenge einer chemischen Reaktion. Die Reaktionsenthalpie ist unabhängig vom Reaktionsweg und hängt allein vom Anfangs- und Endzustand der Reaktion ab.

Es gilt:

Entropie
Die Entropie (S) ist ein Maß für die Unordnung in einem System. Je größer S, desto größer ist die Unordnung in einem System. Die Entropie einer Reaktion wird üblicherweise ebenfalls als Entropieänderung (ΔS) angegeben. Sie umfasst die Entropieänderung des Systems und der Umgebung.

Es gibt verschiedene Arten, durch die die Entropie eines Systems erhöht wird, wie z.B.:
- Zunahme der Teilchen
- Änderung Aggregatzustand (fest<flüssig<gasförmig)
- Zunahme Temperatur (und somit Bewegung der Teilchen)
- Volumenerhöhung
Gibbs-Helmoltz-Gleichung
Die Gibbs-Helmoltz-Gleichung beschreibt den Zusammenhang zwischen Enthalpie und Entropie in Abhängigkeit von der Temperatur. Mithilfe dieser kann auf einfache Weise berechnet werden ab welcher Temperatur eine Reaktion spontan abläuft. Spontane Reaktionen sind Reaktionen, die bei Raumtemperatur ohne äußere Einwirkung ablaufen.