Elektrochemie
Elektrochemische Spannungsreihe
In der Elektrochemischen Spannungsreihe sind Redoxpaare nach ihrem Standard-Elektronenpotential, auch "Redoxpotential" genannt, aufgelistet. Das Standard-Elektronenpotential ergibt sich aus dem Vergleich mit einer Standardwasserstoff-Halbzelle. Dementsprechend hat die Standard-Wasserstoffhalbzelle ein Standard-Elektronenpotential von 0. In der folgenden Tabelle stehen oben in die Redoxpaare mit größerem Standard-Elektronenpotential (edle Metalle) und unten die Paare mit kleinerem Standard-Elektronenpotential (unedle Metalle).
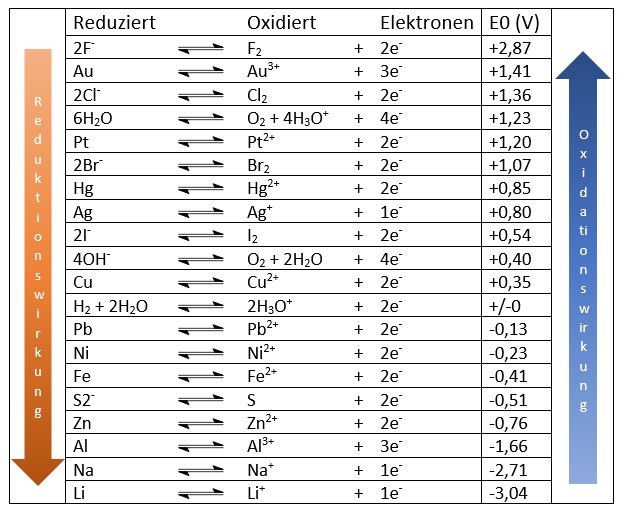
Je größer das Redoxpotential ist, desto stärker ist die Oxidationswirkung des Redoxpaars. Je kleiner das Redoxpotential, desto größer ist dessen Wirkung als Reduktionsmittel. Mithilfe der Elektrochemische Spannungsreihe kann man herausfinden, ob eine Reaktion stattfindet oder nicht.
Elektrolyse
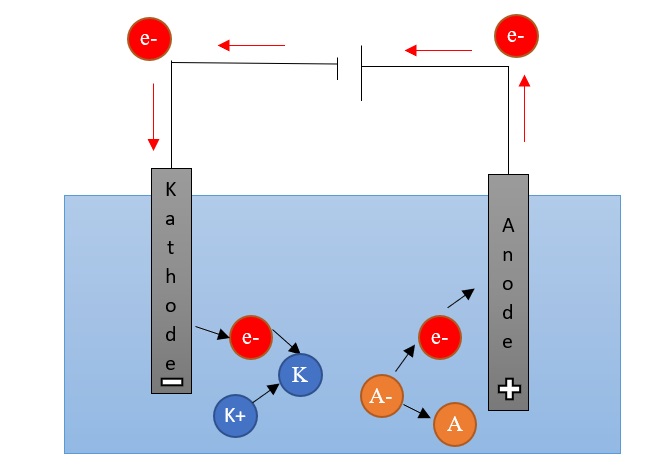
Bei der Elektrolyse befinden sich zwei Elektroden in einer Flüssigkeit, welche Ionen enthällt. Wird eine Spannung zwischen den Elektroden angelegt, so bildet sich an der einen Elektrode der Pluspol (Anode) und and der anderen Elektrode ein Minuspol (Kathode) aus. Die Anionen aus der Lösung wandern nun zur positiv geladenen Anode, wo sie Elektronen abgeben. Diese Elektronen fließen durch einen Leiter zur Kathode. Die Kationen wandern zur negativ geladenen Kathode und nehmen dort Elektronen auf. Somit läuft an der Anode die Oxidation ab und an der Kathode die Reduktion. Die Spannung, die angelegt werden muss, damit die Elektrolyse stattfindet, hängt von den Ionen in der Lösung ab.
Galvanische Zelle
In einer galvanischen Zelle laufen die Oxidation und Reduktion einer Redox-Reaktion getrennt voneinander in sogenannten "Halbzellen" statt. In den Halbzellen befinden sich die Metalle jeweils als Reinelement an der Elektrode und als Ion in der Flüssigkeit, welche die Elektrode umgibt. In der Halbzelle mit dem unedleren Metall befindet sich der Minuspol, welcher hier Anode genannt wird. In der Halbzelle mit dem edleren Metall befindet sich der Pluspol (Kathode).
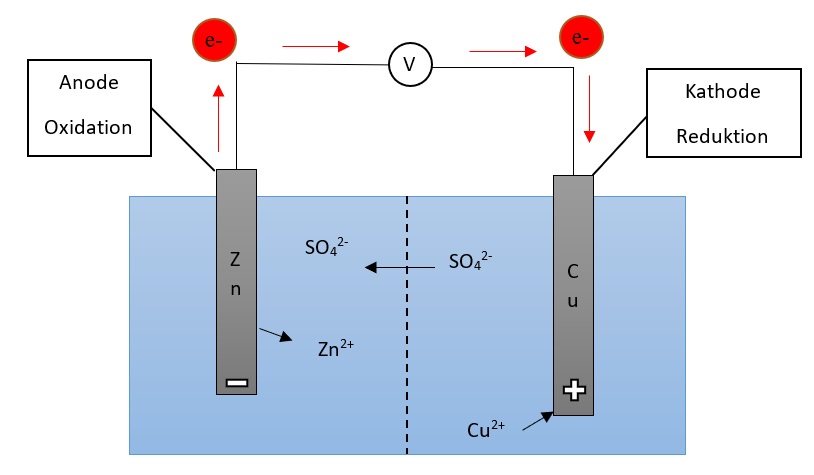
Dadurch, dass sich zwei verschiedene Metalle in den unterschiedlichen Halbzellen befinden, entsteht eine Spannung. An der Anode geht das Metall als positiv geladene Kationen in die Lösung über. Dadurch entsteht eine negative Ladung an der Anode. An der Kathode scheiden sich die positiv geladenen Metallionen aus der Lösung an der Elektrode ab, sodass dort das Elementare Metall entsteht und die Elektronen in Lösung bleiben. An der Anode findet somit eine Oxidation statt und an der Kathode die Reduktion.
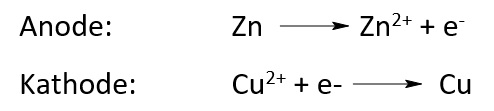
Die Elektronen sind mit einem Leiter verbunden, welcher Elektronen leitet. Damit nicht nur eine Spannung, sondern auch ein geschlossener Stromkreis entsteht, sind die Lösungen in den Zellen mit einem Ionenleiter verbunden.
Beispiele
Batterie:
Eine Batterie funktioniert im Prinzip wie eine Galvanische Zelle.
Akkumulator:
Akkumulatoren werden umgangssprachlich auch "Akkus" genannt. Beim Entladevorgang funktionieren Akkus auf dieselbe Weise wie eine Batterie. Wird ein Akku mit einer Ladestation verbunden, so beginnt der Ladevorgang. Hier wird der Entladevorgang wieder rückgängig gemacht. Dies geschieht nach dem Prinzip der Elektrolyse.
Korrosion
Korrosion ist die Zerstörung eines Metalls aufgrund einer Oxidationsreaktion mit Sauerstoff und Wasser. Bei der Korrosion von Eisen entsteht Rost.
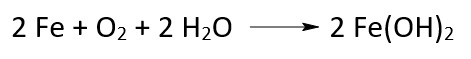
Zur Verhinderung der Korrosion wird oft ein aktiver oder passiver Korrosionsschutz angewandt.

