Atommodelle
Dalton
Daltons Atommodell ist das Erste, welches je kreiert wurde. Das Modell ist jedoch eine sehr vereinfachte Darstellung. Laut Dalton besitzt ein Atom die folgenden 4 Kerneigenschaften:
- Jeder Stoff besteht aus kleinsten, nicht weiter teilbaren kugelförmigen Teilchen, den Atomen.
- Alle Atome eines bestimmten Elements haben das gleiche Volumen und die gleiche Masse. Atome unterschiedlicher Elemente unterscheiden sich in ihrem Volumen und in ihrer Masse.
- Atome sind unzerstörbar. Sie können durch chemische Reaktionen weder vernichtet noch erzeugt werden.
- Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe nur neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verbunden.
Rutherford
Rutherford kam zu seinem Atommodel mithilfe eines Streuversuchs. Er beschoss eine hauchdünne Goldfolie mit α-Teilchen. Die meisten Teilchen gingen geradewegs durch die Folie hindurch. Andere Teilchen wurden aber in verschiedene Richtungen abgelenkt und einige sogar zurückgeworfen.
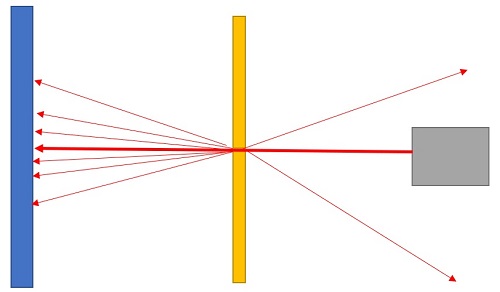
Mithilfe seines Versuchs entwickelte Rutherford das Kern-Hülle-Modell eines Atoms. Demnach besteht ein Atom aus drei verschiedenen Teilchen-Arten:


Bei ungeladenen Atomen ist die Anzahl der Elektronen gleich der Anzahl der Protonen. Protonen und Neutronen werden zusammengefasst als "Nukleonen" bezeichnet. Zudem bestehen große Freiräume zwischen den verschiedenen Teilchen eines Atoms. Die Elektronen bewegen sich auf Kreisbahnen um den Atomkern herum. Die Anziehungskraft zwischen Protonen und Elektronen ist dabei so groß wie die Fliehkraft, mit der die Elektronen den Kern umkreisen.
Bohr
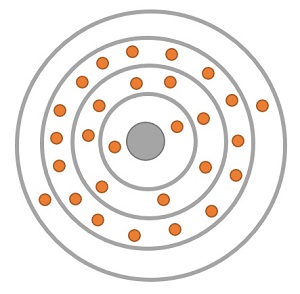
Das Bohr'sche Atommodell wird auch als "Schalenmodell" bezeichnet. Dieser Begriff beruht darauf, dass die Elektronen sich laut Bohr in bestimmten Abständen vom Atomkern entfernt aufhalten. Diese Abstände werden als Schalen bezeichnet. Das Modell basiert auf der Annahme, dass die Elektronen sich stets auf einem möglichst niedrigem Energieniveau befinden. Diese unterschiedlichen Schalen können jeweils eine verschiedene Anzahl an Elektronen aufnehmen.

Ist eine Schale voll besetzt, so wird begonnen, die nächste Schale aufzufüllen usw.. Dies beginnt bei der Schale, welche sich am dichtesten am Atomkern befindet, hin zu den immer weiter außen liegenden Schalen. Elektronen auf nicht vollbesetzten Schalen bezeichnet man als "Valenzelektronen".
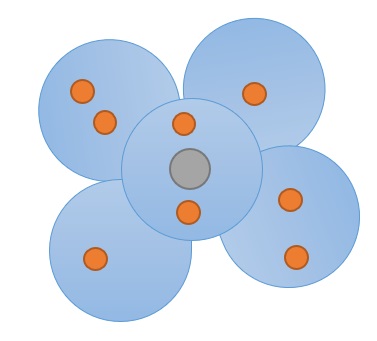
Orbitalmodell
Mithilfe des Orbitalmodells kann man vermuten in welchen Bereichen sich die Elektronen eines Atoms befinden könnten. Diese Bereiche werden auch "Kugeln" genannt. Die Anzahl der vorhandenen Kugeln ist von der Art der Schale abhängig. Jede Kugel bietet Platz für zwei Elektronen.

Jedes Elektron hat einen Spin, also eine Richtung, in die es sich dreht. Die Elektronen einer Kugel bewegen sich in jeweils entgegengesetzte Richtungen. Die Kugeln werden zunächst nur mit einem Elektron befüllt. Erst wenn alle Kugeln bereits ein Elektron aufgenommen haben, wird von den Kugeln jeweils ein zweites Elektron aufgenommen.
Ein Elektron kann außerdem durch vier Quantenzahlen beschrieben werden. Diese bestimmen die Position und Eigenschaften dieses Elektrons.

